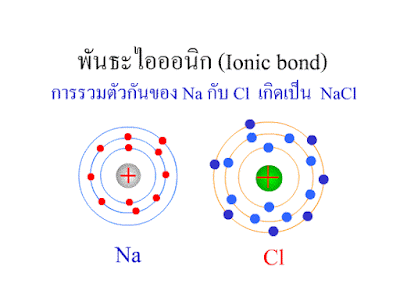
พันธะไอออนิก (
Ionic bond )
หมายถึง
พันธะระหว่างอะตอมที่อยู่ในสภาพอิออนที่มีประจุตรงกันข้ามกัน ซึ่งเกิดจากการเคลื่อนย้ายอิเล็กตรอน
11 ตัว หรือมากกว่า จากอิเล็กตรอนวงนอกสุดของอะตอมหนึ่งไปยังอีกอะตอมหนึ่ง
เพื่อให้จำนวนอิเล็กตรอนวงนอกสุด ครบออกเตต
ซึ่งเกิดขึ้นระหว่างอะตอมของโลหะกับอโลหะ
โดยที่โลหะเป็นฝ่ายจ่ายอิเล็กตรอนในระดับพลังงานชั้นนอกสุดให้กับอโลหะ
เนื่องจากโลหะมีค่าพลังงานไอออไนเซชันต่ำ
และอโลหะมีค่าพลังงานไอออไนเซชันสูง
ดังนั้นพันธะไอออนิกจึงเกิดขึ้นระหว่างโลหะกับอโลหะได้ดี กล่างคือ
อะตอมของโลหะให้เวเลนต์อิเล็กตรอนแก่อโลหะ แล้วเกิดเป็นไอออนบวกและไอออยลบของอโลหะ
เพื่อให้เวเลนต์อิเล็กตรอนเป็นแปด แบบก๊าซเฉื่อย
ส่วนอโลหะรับเวเลนต์อิเล็กตรอนมานั้นก็เพื่อปรับตัวเองให้เสถียรแบบก๊าซเฉื่อยเช่นกัน
ไอออนบวกกับไอออนลบจึงดึงดูดระหว่างประจุไฟฟ้าต่างกันเกิดเป็น สารประกอบ
ไอออนิก( Ionic
compuond) ดังนี้
การเกิดสารประกอบโซเดียมคลอไรด์
( NaCl
) จากโซเดียม (Na) อะตอมกับคลอรีน (Cl)
อะตอม
โซเดียมเสียอิเล็กตรอนให้แก่คลอรีน 1 ตัว
ทำให้อะตอมของโซเดียมมีเวเลนต์อิเล็กตรอน= 8
(อะตอมจะเสถียรเป็นไปตามกฎออกเตต)และทำให้มีจำนวนอิเล็กตรอนน้อยกว่าโปรตอน1ตัวทำให้อะตอมโซเดียมแสดงอำนาจไฟ
เป็นประจุบวก(+) ส่วนอะตอมคลอรีนรับอิเล็กจากโซเดียมมา 1 ตัวทำให้อะตอมของคลอรีนมีเวเลนต์อิเล็กตรอน=8(อะตอมเสถียรเป็นไปตามกฎออกเตต)
และทำให้มีจำนวนอิเล็กตรอนมากกว่าโปรตรอน 1 ตัว
ทำให้อะตอมคลอรีนแสดงอำนาจไฟฟ้าเป็นประลบ(-)
โซเดียมอิออนบวก(+) และคลอไรด์อิออน (-)
จะดึงดูดกัน เพราะมีประจุไฟฟ้าทีต่างกัน เกิดเป็น "พันธะไอออนิก"
การเกิดสารประกอบแมกนีเซียมคลอไรด์
จากแมกนีเซียมอะตอม(Mq) และคลอรีนอะตอม(Cl)
อะตอมแมกนีเซียมมีการจัดเรียงอิเล็กตรอนเป็น
Mg = 2, 8, 2
แมกนีเซียมมีเวเลนต์อิเล็กตรอน = 2 ดังนั้น
แมกนีเซียมจะจ่ายอิเล็กตรอนให้แก่คลอรีนอะตอม 2 ตัว เพื่อให้เวเลนต์อิเล็กตรอนเป็น
8 จึงจะเสถียรเหมือนก๊าซเฉื่อย
ทำให้อะตอมของแมกนีเซียมมีจำนวนอิเล็กตรอนน้อยกว่าโปรตอน 2 ตัว
จึงแสดงอำนาจไฟฟ้าเป็นประจุ 2+
แมกนีเซียมไอออนบวก(Mq 2+)และคลอไรด์ไอออนลบ(Cl -) จะเกิดแรงดึงดูดกัน
เพราะมีประจุไฟฟ้าต่างกันเป็นโมเลกุลของแมกนีเซียมคลอไรด์
การเกิดพันธะไอออนิกในสารประกอบ
แบเรียมออกไซด์ ( BaO )
การจัดเรียงอิเล็กตรอนของแบเรียม Ba = 2, 8, 18, 18, 8, 2
( Ba มีเวเลนต์อิเล็กตรอน = 2) และการจัดเรียงอิเล็กตรอนของออกซิเจน O =
2, 6
( O มีเวเลนต์อิเล็กตรอน = 6 ) Ba เสียอิอล็กตรอนให้ O
จำนวน 2 ตัว Ba จึงมีประจุเป็น 2+ ส่วน O
ได้รับอิเล็กตรอนมา2 ตัว จึงมีประจุไฟฟ้าเป็น 2-
เกิดแรงยึดเหนี่ยวด้วยประจุไฟฟ้าต่างกัน เป็นโมเลกุลของแบเรียมออกไซด์
ลักษณะสำคัญของสารประกอบไอออนิก
1. พันธะไอออนิกเป็นพันธะที่เกิดจาก
ไอออนของโลหะ + ไอออนของอโลหะ เช่น NaCl, MgO, KI
2. พันธะไอออนิก
อาจเป็นพันธะเคมีที่เกิดจากธาตุที่มีค่าพลังงานไอออไนเซชันต่ำกับธาตุที่มีค่าพลังงานไอออไนเซชันสูง
3. พันธะไอออนิก
อาจเป็นพันธะที่เกิดจากไอออบวกที่เป็นกลุ่มอะตอมของอโลหะ เช่น
4. สารประกอบไอออนิกไม่มีสูตรโมเลกุล
มีแต่สตรเอมพิริคัล ( สูตรอย่างง่าย )
5.สารประกอบไอออนิกมีจุดดือดและจุดหลอมเหลวสูง
6. สารประกอบไอออนิกในภาวะปกติเป็นของแข็ง
ประกอบไอออนบวกและไอออนลบ ไอออนเหล่านี้ไม่เคลื่อนที่ ดังนั้นจึงไม่นำไฟฟ้า
แต่เมื่อหลอมเหลวหรือละลายน้ำ จะแตกตัวเป็นอิออนและเคลื่อที่ได้
เกิดเป็นสารอิเล็กโทรไลดต์จึงนำไฟฟ้าได้
โครงสร้างของสารประกอบไอออนิก
โครงสร้างของสารประกอบไอออนิกมีลักษณะเป็นโครงผลึกร่างตาข่าย
ประกอบด้วยไอออนบวกและไอออนลบสลับกัน ไม่สามารถแบ่งแยกเป็นโมเลกุลเดี่ยวๆได้
ดังนั้นจึงไม่สามารถทราบขอบเขตของไอออนของธาตุต่างๆใน 1 โมเลกุลได้
แต่สามารถหาอัตราส่วนอย่างต่ำของไอออนที่เป็นองค์ประกอบเท่านั้น
จึงไม่สามารถเขียนสูตรโมเลกุลของสารประกอบไอออนิกได้ ใช้สูตรเอมพิริคัลแทนสูตรเคมีของสารประกอบไอออนิก
สารประกอบไอออนิก
เมื่อโลหะทำปฏิกิริยากับอโลหะ
ธาตุทั้งสองจะรวมกันด้วยพันธะไอออนิกเกิดเป็นสารประกอบไอออนิก
โดยอะตอมของโลหะจะให้(จ่าย,เสีย)เวเลนต์อิเล็กตรอนแก่อะตอมของอโลหะ
ดังนั้นธาตุหมู่ 1A ซึ่งมีเวเลนต์อิเล็กตรอนเท่ากับ 1
จึงเกิดเป็นไอออนที่มีประจุ +1 ธาตุหมู่ 2 ซึ่งมีเวเลนต์อิเล็กตรอนเท่ากับ 2
เมื่อเกิดเป็นไอออนจะมีประจุ +2 เป็นต้น
ส่วนอโลหะซึ่งมีจำนวนเวเลนต์อิเล็กตรอนใกล้เคียงกับก๊าซเฉื่อยจะรับอิเล็กตรอนมาให้ครบแปด
เช่น ธาตุหมู่ 7A จะรับอิเล็กตรอน 1 ตัว
เมื่อกลายเป็นไอออนจะมีประจุ -1 สำหรับธาตุหมู่ 5 และหมู่ 6 เมื่อเกิดเป็นไอออนจะมีประจุ
-3 และ -2ตามลำดับ เนื่องจากสามารถรับอิเล็กตรอนได้ 3 และ 2
อิเล็กตรอนแล้วมีการจัดเรียงอิเล็กตรอนตามกฎออกเตต
การเขียนสูตรและการเรียกชื่อสารประกอบไอออนิก
ธาตุหมู่
I
II
II
IV
V
VI
VII
ประจุบนไอออน
+1
+2
+3
-4
-3
-2
-1
ก. การเขียนสูตรสารประกอบไอออนิก
ใช้หลักดังนี้
1.
เขียนไอออนบวกของโลหะหรือกลุ่มไอออนบวกไว้ข้างหน้า
ตามด้วยไอออนลบของอโลหะหรือกลุ่มไอออนลบ
2. ไอออนบวกและไอออนลบ
จะรวมกันในอัตราส่วนที่ทำให้ผลรวมของประจุเป็นศูนย์
ดังนั้นจึงต้องหาตัวเลขมาคูณกับจำนวนประจุบนไอออนบวกและไอออนลบให้มีจำนวนเท่ากัน
แล้วใส่ตัวเลขเหล่านั้นไว้ที่มุมขวาล่างของแต่ละไอออน
ซึ่งทำได้โดยใช้จำนวนประจุบนไอออนบวกและไอออนลบคูณไขว้กัน
3. ถ้ากลุ่มไอออนบวกหรือไอออนลบมีมากกว่า 1
กลุ่ม ให้ใส่วงเล็บ ( ) และใส่จำนวนกลุ่มไว้ที่มุมล่างขวาล่าง ดังตัวอย่าง
จงเขียนสูตรของสารประกอบไอออนิกต่อไปนี้
ก. Na+ กับ O2- ข. Ca2+ กับ Cl-
ค. NH4+ กับ SO42-
ข. การอ่านชื่อสารประกอบไอออนิก
1. สารประกอบธาตุคู่ ถ้าสารประกอบเกิดจาก
ธาตุโลหะที่มีไอออนได้ชนิดเดียวรวมกับอโลหะ ให้อ่านชื่อโลหะที่เป็นไอออนบวก
แล้วตามด้วยชื่อธาตุอโลหะที่เป็นไอออนลบ โดยเปลี่ยนเสียงพยางค์ท้ายเป็น ไอด์ (ide) เช่น
-ออกซิเจน เปลี่ยนเป็น ออกไซด์ (oxide)
-ไฮโดรเจน เปลี่ยนเป็น ไฮไดรด์ (hydride)
-คลอรีน เปลี่ยนเป็น คลอไรด์ (chloride)
-ไอโอดีน เปลี่ยนเป็น ไอโอไดด์ (iodide)
NaCl อ่านว่า โซเดียมคลอไรด์ (Sodium chloridr)
CaI2 อ่านว่า แคลเซียมไอโอไดด์ (Calcium iodide)
KBr อ่านว่า โพแทสเซียมโบรไมด์ (Potascium bromide)
CaCl2 อ่านว่า แคลเซียมคลอไรด์ (Calcium chloride)
ตัวอย่างการอ่านชื่อสารประกอบไอออนิกธาตุคู่
ถ้าสารประกอบที่เกิดจากธาตุโลหะเดีนวกันที่มีไอออนได้หลายชนิด
รวมตัวกับอโลหะ
ให้อ่านชื่อโลหะที่เป็นไอออนบวกแล้วตามด้วยค่าประจุของไอออนของโลหะโดยวงเล็บเป็นเลขโรมัน
แล้วตามด้วยอโลหะที่เป็นไอออนลบ โดยเปลี่ยนเสียงพยางค์ท้ายเป็น ไอด์ (ide) เช่น Fe เกิดไอออนได้ 2 ชนิดคือ Fe 2+ และ Fe 3+ และCu เกิดอิออนได้
2 ชนิดคือ Cu + และ Cu 2+
สารประกอบที่เกิดขึ้นและการอ่านชื่อ ดังนี้
FeCl2 อ่านว่า ไอร์ออน (II) คลอไรด์ ( Iron (II)
chloride )
CuS อ่านว่า คอปเปอร์ (I) ซัลไฟด์ ( Cupper (I)
sunfide )
FeCl3 อ่านว่า ไอร์ออน (III) คลอไรด์ ( Iron
(III) chloride )
Cu2S อ่านว่า คอปเปอร์ (II) ซัลไฟด์
( Copper (II) sunfide )
2. สารประกอบธาตุสามหรือมากกว่า
ถ้าสารประกอบเกิดจากไอออนบวกของโลหะ หรือกลุ่มไอออนบวกรวม
ตัวกับกลุ่มไอออนลบ
ให้อ่านชื่อไอออนบวกของโลหะหรือชื่อกลุ่มไอออนบวก แล้วตามด้วยกลุ่มไอออนลบ เช่น
CaCO3 อ่านว่า แคลเซียมคาร์บอนเนต (Calcium carbonatX
KNO3 อ่านว่า โพแทสเซียมไนเตรต (Potascium nitrae)
Ba(OH)2 อ่านว่า แบเรียมไฮดรอกไซด์ (Barium hydroxide)
(NH4)3PO4 อ่านว่า แอมโมเนียมฟอสเฟต (Ammomium
pospate)
การละลายของสารประกอบไอออนิก
สารประกอบไอออนิกบางชนิดละลายน้ำได้ดีและบางชนิดไม่ละลายน้ำ
การที่สารประกอบไอออนิกละลายน้ำได้เนื่องจากแรงดึงดูดระหว่างโมเลกุลของน้ำกับไอออนมีค่ามากกว่าแรงยึดเหนี่ยวระหว่างไอออนบวกกับไอออนลบ
เช่น เมื่อนำโซเดียมคลอไรด์มาละลายในน้ำ แรงดึงดูดระหว่างโมเลกุลของน้ำกับโซเดียมไอออน
และน้ำกับคลอไรด์ไอออนมีค่าสูงกว่าแรงยึดเหนี่ยวระหว่างไอออนทั้งสอง
โซเดียมคลอไรด์จึงละลายน้ำได้ เมื่อไอออนเหล่านี้หลุดออกจากโครงสร้างเดิม
แต่ละไอออนจะถูกล้อมรอบด้วยโมเลกุลของน้ำหลายๆโมเลกุล
โดยน้ำจะหันขั้วที่มีประจุตรงกันข้ามเข้าไอออนที่ล้อมรอบ
ในการละลายน้ำของสารประกอบไอออนิก
จะมีขั้นย่อยๆของการเปลี่ยนแปลง 2 ขั้นตอน ดังนี้
ขั้นที่ 1
ผลึกของสารประกอบไอออนิกสลายตัวออกเป็นไอออนบวกและลบในภาวะก๊าซ
ขั้นนี้ต้องใช้พลังงานเพื่อสลายผลีก พลังงานนี้เรียกว่า พลังงานโครงร่างผลึก ( latece energy
) , E1
ขั้นที่ 2
ไอออนบวกและไอออนลบในภาวะก๊าซรวมตัวกับน้ำ ขั้นนี้มีการคายพลังงาน
พลังงานที่คายออกมาเรียกว่า พลังงานไฮเดรชัน (Hydration energy ) , E2
พลังงานของการละลาย ( D E) มีค่า = E1 + E2
พลังงานของการละลายพิจารณาจากพลังงานโครงร่างผลึก ( E1 )
และพลังงานไฮเดรชัน( E2 ) ดังนี้
1.ถ้าค่า D E< 0 ( E1 < E2 ) การละลายจะเป็นแบบคายพลังงาน
2.ถ้าค่าD E > 0 ( E1 > E2 ) การละลายจะเป็นแบบดูดพลังงาน
3.ถ้าD E = 0 ( E1
= E2 ) การละลายจะไม่คายพลังงาน
4.ถ้า พลังงานโครงร่างผลึกมีค่ามากกว่าพลังงานไฮเดรชันมากๆ
( E1 >>>> E2 ) จะไม่ละลายน้ำ